
一种无蛋白质图案、基于物理线索的细胞自组织方法。
Introduction
思路:
多细胞空间组织驱动着形态发生、发育、愈合和稳态,其破坏与疾病发生和病理过程发展有关。多细胞组织受各种环境线索的调节,包括信号分子、转录或生长因子等生化物质以及应力、剪切、硬度和几何形状等物理参数。例如,血管细胞的多细胞组织受生化物质的浓度和活性控制,如信号素3E(semaphorin 3E)、血小板衍生生长因子(platelet-derived growth factor)和血管内皮生长因子(vascular endothelial growth factor),以及包括机械拉伸和剪切的物理因素。以上因素的改变可能导致病变,如内皮增生和毛细血管形状、直径和渗透性的异常。
水凝胶合成和微尺度图案化的最新进展发现了刚度和细胞组织中的几何形状之间的互动线索。例如,上皮细胞在一定硬度下的水凝胶上会聚集形成管腔结构,随着硬度增加,则会变成单层结构。
过去关于细胞组织的研究:
- 二维组织往往基于不同粘附(如胶原和纤连蛋白)和非粘附(如Pluronic®)图案产生的;
- 三维组织通常研究细胞排列和迁移,但往往使用的是非生理性的硬度≥1 MPa的基底(如PDMS)。
在这里,作者报道了在无蛋白质图案的、位于模量为2 kPa的软水凝胶微孔中的、基于物理线索(硬度和微孔长宽比)的内皮细胞自组织的一种新模式。
Endothelial Cells Self-Organize into Ring-Like Patterns on Soft Hydrogel Microwells in the Absence of Protein Patterns
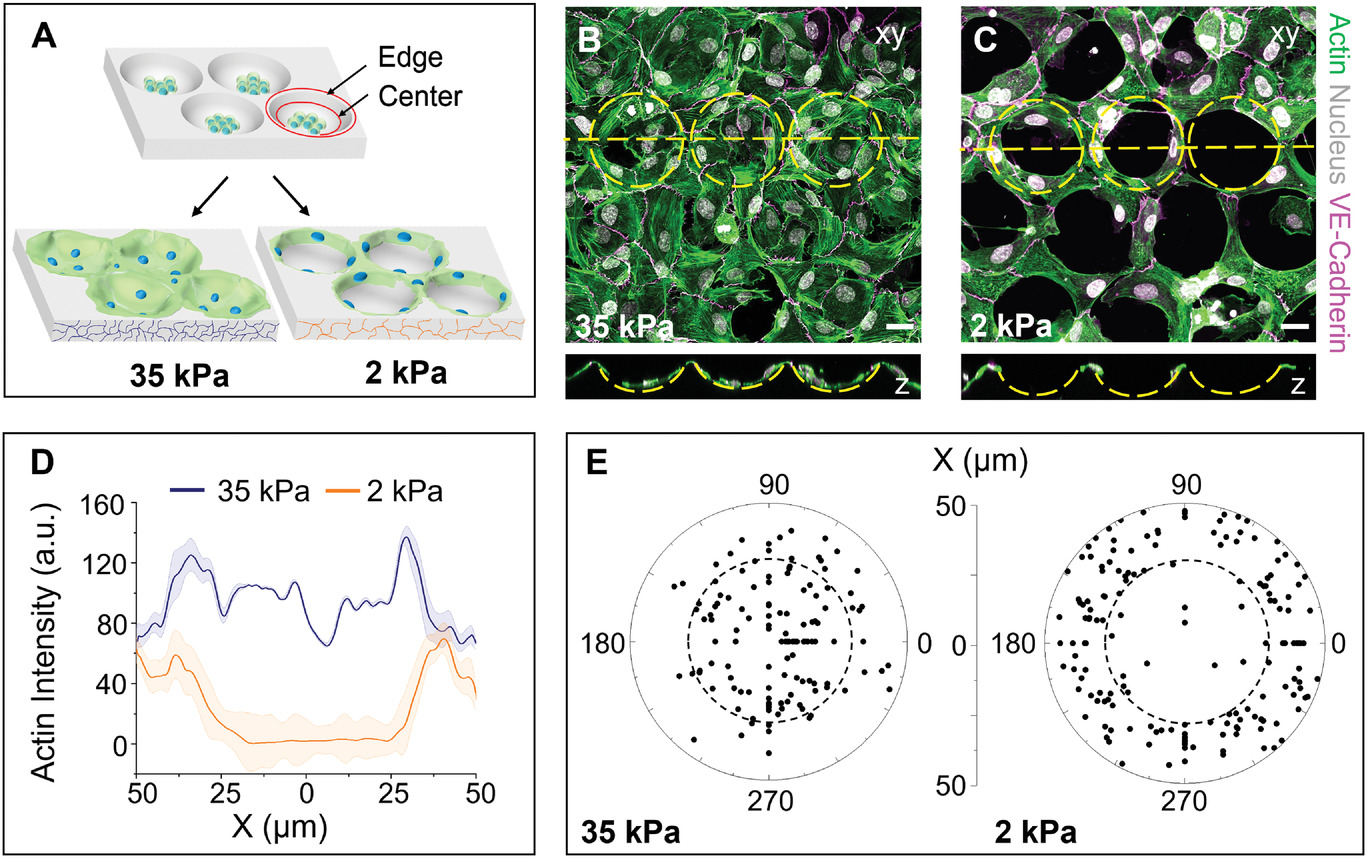
- (A)在无基底蛋白质图案的情况下由形状和硬度驱动的多细胞组织发生的示意图。90%以上的细胞在柔软的2 kPa明胶水凝胶上向微孔边缘迁移并组织起来,而较硬的35 kPa水凝胶上的细胞则均匀地分布在整个微孔中。
- (B)共聚焦显微图像显示均匀的多细胞分布在坚硬的35 kPa水凝胶微孔区域各处。
- (C)相比之下柔软的2 kPa水凝胶微孔的边缘有明显的环状多细胞自组织。
- (D)沿着微孔直径X(图BC黄线)测量的肌动蛋白强度图。
- (E)极坐标图描述了微孔中细胞的分布,通过测量细胞核中心与微孔中心的距离进行量化。
The Topography and Mechanical Properties of the Hydrogel Microwells are Uniform

- (A-B)倾斜的35 kPa的硬微孔和2 kPa的软微孔的SEM显微照片,放大的部分(A’、B’)集中在微孔的边缘,显示微孔的表面拓扑结构是均匀的,且边缘相似。
- (C)坚硬的35 kPa的硬微孔和2 kPa的软微孔的代表性布里渊显微图像,白色的弧线表示PBS和水凝胶的边界。热图刻度表示布里渊位移,单位为GHz。
- (D)沿着水凝胶-液体界面下方的直径(X),微孔表面的布里渊位移。位移在整个微孔表面是均匀的,证实了水凝胶微孔的机械均匀性。
布里渊显微镜:基于光学弹性成像,是一种非破坏性、无标记和无接触的方法,可以在三维中以衍射极限分辨率探测生物样品的粘弹性特性。原理见此综述。
Self-Organization Occurs in Soft 2 kPa Microwells of Different Shapes

- (A-C)三角形、方形和圆形的微孔的示意图和光学图像。(A’-C’)为对应的微孔中细胞的俯视图。
- (D)不同形状的微孔中细胞的分布(DR)箱线图,没有显著差异。
Self-Organization Depends on the Microwell Aspect Ratio

- (A)2 kPa的软微孔中,长宽比(ε)与细胞分布(DR)之间的关系量化。保持周长为250 μm不变,深度超过10 μm的微孔(ε<25),细胞从中心迁移到边缘;随着深度减小(ε增大),更多的细胞倾向于停留在中心区域。
- (B)共聚焦显微图像显示在软的2 kPa微孔中,细胞染色的肌动蛋白(绿色)和细胞核(灰色)的顶部(xy)和侧视图(z),从左到右深度不断减少(ε增加)。以上结果表明,微孔长宽比显著影响细胞自组织。
Multicellular Self-Organization Occurs at an Optimal Cell Density
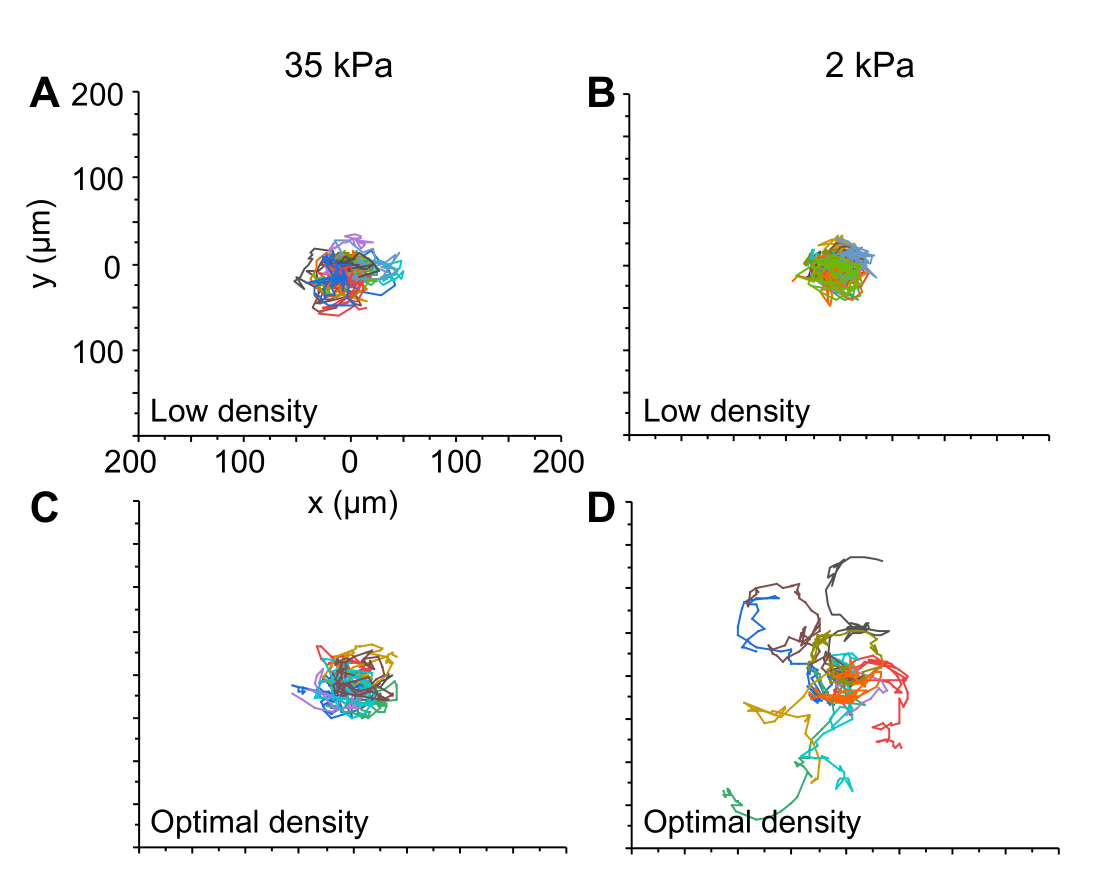
- (A-D)在低细胞密度(A、B)和最佳细胞密度(C、D)的35 kPa硬微孔和2 kPa软微孔中的细胞迁移轨迹。在最佳接种密度下,每个微孔有3-5个细胞,使它们能够进行细胞间粘附;而在低密度下,每个微孔仅有1个细胞。
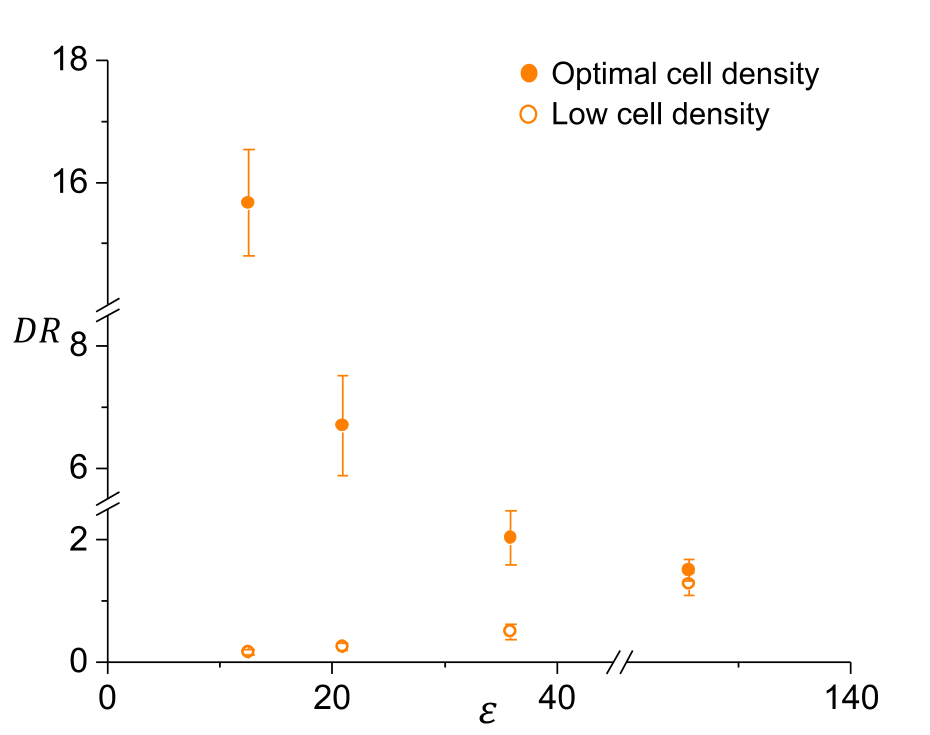
在低细胞密度下,细胞主要分布在2 kPa软微孔的中心。上图描述了2 kPa软微孔中最佳(实心圆)和低(开口圆)细胞密度下的细胞分布(DR)与微孔长宽比(ε)的关系。以上结果表明,细胞与细胞之间的相互作用对2 kPa微孔边缘的细胞自组织中起作用。
Delineating the Role of Substrate Stiffness on Multicellular Self-Organization by Regulating Cell Contractility

多细胞自组织成环状结构只发生在软的2 kPa微孔中,而不是硬的35 kPa微孔。这一观察表明,基质硬度是导致观察到的自组织的一个调节因素。已知基质硬度会影响细胞大小、细胞骨架收缩性和细胞粘附。
- (A)35 kPa和2 kPa微孔中细胞的投影面积箱线图。
- (B)35 kPa和2 kPa微孔中20小时内发生的细胞分裂箱线图。基于以上结果,假设细胞行为的差异可能部分是由于两种水凝胶上的细胞骨架收缩性的不同所致。

随后通过使用药物改变细胞收缩性来验证这一假设。使用Rho相关激酶(Rho-associated kinase,ROCK)抑制剂Y27632(30×10-6 M)抑制细胞中Rho激活、肌球蛋白II依赖的微丝细胞骨架的收缩性。在平行实验中,用磷酸酶抑制剂Calyculin A(0.1×10-9 M)抑制肌球蛋白的去磷酸化和失活,以增加微丝细胞骨架的收缩性。
- (A-B)共聚焦显微图像显示Y27632处理的细胞在硬的35 kPa微孔(A)和软的2 kPa微孔(B)中染色的肌动蛋白(绿色)和细胞核(灰色)的俯视图。注意到接种在硬的35 kPa微孔的细胞中,ROCK的抑制导致微孔边缘的自组织。
- (C-D)共聚焦显微图像显示Calyculin A处理的细胞在硬的35 kPa微孔(C)和软的2 kPa微孔(D)中染色的肌动蛋白(绿色)和细胞核(灰色)的俯视图。注意到接种在软的2 kPa微孔的细胞中,Calyculin A处理导致微孔边缘的自组织消失。
- (E-F)极坐标图描述了微孔中细胞的分布,对应于(A-D)中的条件。

上图描述了在35 kPa和2 kPa微孔中用Y27632(细胞收缩性降低)或Calyculin A(细胞收缩性增加)处理的细胞的分布比(DR)。以上结果表明:细胞骨架收缩性(由基质硬度决定)是指导细胞自组织的重要因素,较硬的基质抑制了在由较软基质组成的微孔中观察到的几何增强的细胞运动。
Influence of Cell–Cell and Cell–Substrate Interaction on Multicellular Self-Organization
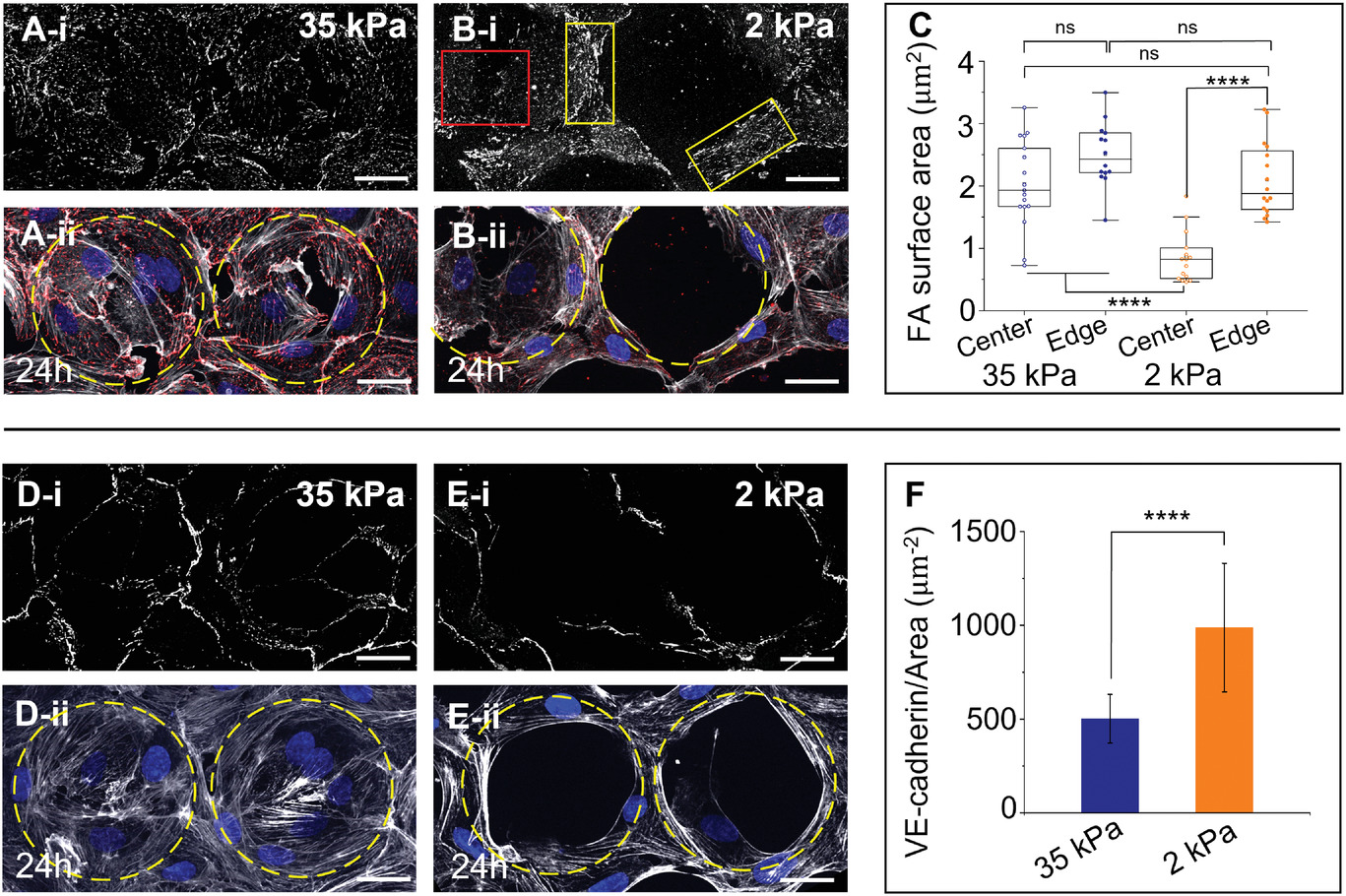
- (A-B)共聚焦显微图像分别显示在35 kPa硬孔和2 kPa软孔中接种后24 小时免疫标记的粘着斑(FAs)中的桩蛋白(灰色)的细胞的俯视图(A-i、B-i)和相应桩蛋白(红色)、肌动蛋白(灰色)和细胞核(蓝色)的染色合成俯视图(A-ii、B-ii)。黄色框显示边缘的条纹状FA,红色框显示2 kPa软孔内的点状FA。
- (C)35 kPa硬孔和2 kPa软孔中心和边缘的细胞的FA大小箱线图。因此35 kPa硬孔中细胞的有限迁移可能部分归因于微孔内细胞产生的大FA;相比之下,细胞在2 kPa软孔内形成小得多的 FA,促进它们从微孔中心向边缘运动,在那里它们建立了大的 FA 并稳定了它们的位置。由于ROCK的抑制会由于应力纤维形成减少而减少FA的形成,这可能是Y27632导致35 kPa硬孔细胞迁移行为的机理。
- (D-E)共聚焦显微图像分别显示在35 kPa硬孔和2 kPa软孔中接种后24 小时免疫标记的VE-钙粘蛋白(灰色)的细胞的俯视图(D-i、E-i)和相应肌动蛋白(灰色)和细胞核(蓝色)的染色合成俯视图(D-ii、E-ii)。
- (F)单位连接面积的平均VE-钙粘蛋白强度的量化图。
Balance between Cell Tension, Adhesion, and Cohesion Can Explain the Observed Cell Organization

- (A)描述力平衡模型参数的示意图。该模型分析细胞张力(Fk)、内聚力(Fw)和粘附力(Fη),假设集中在细胞的末端节点,以预测观察到的多细胞组织。
- (B)细胞分布(DR)和微孔纵横比(ε)与细胞排列之间关系的实验观察和理论预测。
- (C-D)描绘各种纵横比(ε)的细胞分布(DR)与(C)细胞骨架张力和(D)细胞间相互作用(细胞密度)的函数关系的图。因此,当细胞被接种在35 kPa硬孔中时,与接种在2 kPa软孔中的细胞相比,细胞骨架刚度更高,VE-钙粘蛋白活性更低,这往往会使细胞更向中心移动,以补偿细胞张力的额外增加。
Discussion
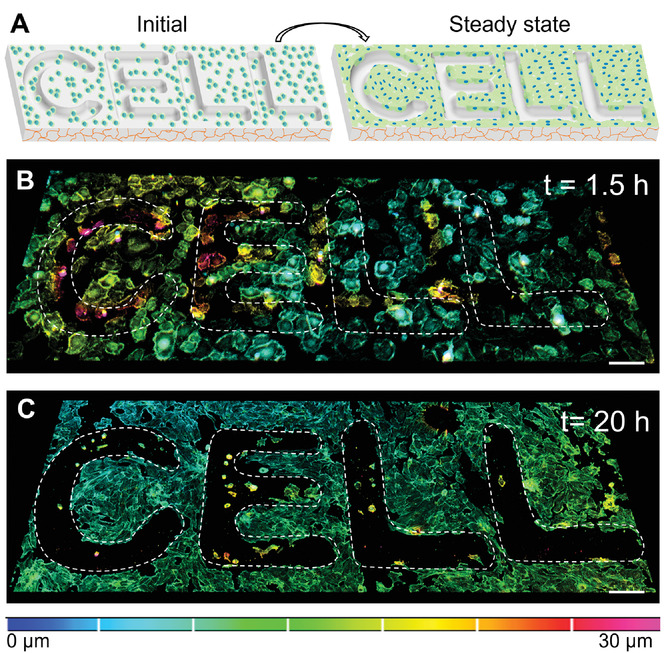
- (A)表示在2 kPa软水凝胶上的初始和稳定后细胞分布的示意图,上面印有CELL字样。
- (B)在接种后1.5小时(初始),2 kPa软水凝胶图案上表达LifeAct-GFP的HUVECs的深度编码共聚焦3D堆栈图。
- (C)在接种后20小时,2 kPa软水凝胶图案上表达LifeAct-GFP的HUVECs的深度编码共聚焦3D堆栈图。表明即使沿着非周期性和不对称的微图案,细胞也可以以良好的保真度自组织。
描述了一种新的多细胞自组织模式,以响应调节细胞迁移和组织形态发生的物理线索。作者通过考虑细胞骨架张力和细胞外力(包括细胞-细胞和细胞-基质粘附)之间平衡的变化来数学解释这一发现。这种力平衡可以通过基质硬度、微环境几何形状的纵横比和细胞密度来调整。
体内的这种扰动会导致自组织能力消失。例如,在高血压、糖尿病和其他血管壁力学改变的血管疾病等病理条件下,ECM变硬导致EC组织成较短或严重扭曲的血管。而作者提出的方案可以通过定义软水凝胶上3D几何形状的纵横比来指导细胞组织,而无需图案化细胞粘附/排斥区域或调节基板曲率。
Reference
Pahapale G J, Tao J, Nikolic M, et al. Directing Multicellular Organization by Varying the Aspect Ratio of Soft Hydrogel Microwells[J]. Advanced Science, 2022.



